
化学学科网初三目录

在化学变化中,分子是分开的,但原子是不分开的。
分子是保持物质化学性质的最小微粒。
原子是化学变化中最小的微粒。
通常物质是由几个分子组成的,但金属有时是由原子直接组成的
原子的构成分子例如:氢原子+氧原子=水的分子。
两者同样可以构成物质如:Cu、Na、Zn等是由原子直接构成的物质;H2O, O2, H2, N2等是分子构成的物质
元素是由许多原子组成的,和分子无关
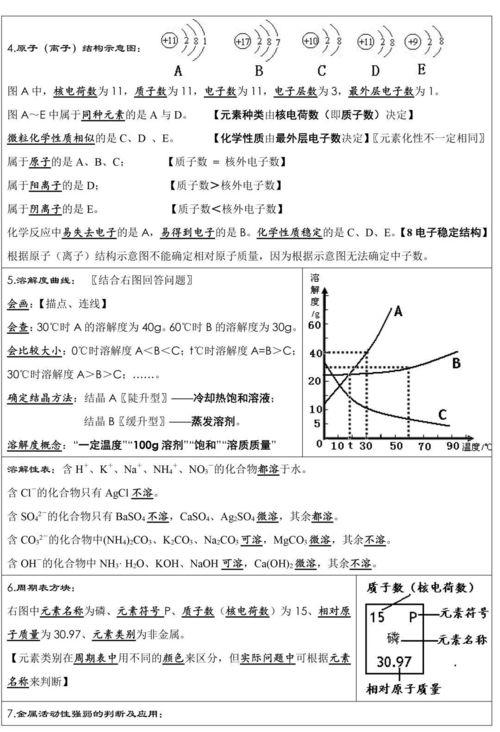
(一)溶液1、溶液:一种或几种物质分散到其他物质上,形成均匀稳定的混合物。叫溶液。
2、溶质:被溶解的物质叫做溶质。
3、溶剂:其他物质称为溶剂。
水是最常用的溶剂,汽油和酒精也是溶剂。
4、悬浊液:固体的小颗粒悬浮在液体中形成的混合物叫悬浊液,悬浊液不匀一、不稳定,一段时间就会分层。
5、浮浊液:小液滴分散在液体中形成的混合物称为浮浊液,浮浊液不均匀,不稳定,一段时间成层。
自然界、工农业生产和日常生活中经常遇到的浮液,如牛奶、石油原油、橡胶乳胶、油漆等。
浮浊液可分为两种类型:一种是油——水型,以O/W表示。
例如,植物油会分散到水里。这个分散系统是油内水外,用O/W表示。
另一种是水——油型,用W/O表示,例如:从地下开采的石油中含有少量分散的水,这种分散系水内油外,用W/O表示。
(二)溶解质1、饱和溶液在一定的温度下,在一定的溶剂中,不能再溶解某种溶质的溶液称为该溶质的饱和溶液。
2、不饱和溶液在一定温度下,在一定量的溶剂中,还能继续溶解某溶质的溶液,称为该溶质的不饱和溶液。
说明:判断一种溶液是否饱和溶液应抓住以下四点:一是在一定温度下,二是在一定量的溶剂中。
因为温度和溶剂的量改变的话,饱和溶液就会变成不饱和溶液。也就是说,饱和溶液和不饱和溶液在一定条件下可以相互转化。第三种是被溶解的物质。也就是说,溶质能否持续溶解。第四,某种物质的饱和溶液对该物质来说是饱和溶液,但对其他物质来说不是饱和溶液。在20℃时,NaCl的饱和溶液不能溶解NaCl,但可以溶解KNO3。
在同一溶质中,饱和溶液和不饱和溶液会发生变化。溶液的浓和稀是定性测量一定量溶液中所含溶质的相对量的多少。溶质多的溶液是浓度。溶质少的溶液是稀。饱和溶液不一定是浓的。不饱和溶液也不一定稀有。在20℃熟石灰的饱和溶液中,Ca(OH)2的溶解较少,是稀溶液,但在60℃时,接近饱和的KNO3溶液是浓溶液,在一定温度下,KNO3饱和溶液比相同温度下的不饱和溶液浓溶液。
(三)溶质的质量分数溶质的质量分数溶液组成的表示方法很多,溶质的质量分数是溶质的质量与溶液的质量之比。
注意:溶解度和溶质质量分数的比较三、难点知识剖析(一)溶解时的吸热和放热现象在溶解过程中发生两个变化,一个是溶质分子(或离子)向水扩散,这个过程吸收热量:另一个第一个是溶质的分子(或离子)和水分子作用,形成水合分子(或水合离子),在这个过程中放出热量。
当溶质溶解时,扩散过程的吸收热大于水合过程的释放热,表示为溶液温度的降低:扩散过程的吸收热大于水合过程的释放热,表示为溶液温度的升高;如果扩散过程中吸收的热量与水合过程中释放的热量相同,那么溶液的温度基本不变。
(二)溶解度与溶解性的区别和关系溶解性只是一般说明在某种溶剂中溶解能力的大小,是物质的一种物理性质,溶解度是测定某种物质在某种溶剂中溶解性大小的尺度,溶解性的定量表示方法,在一定温度、压力下,(三)溶质的质量分数和溶液的体积、密度的计算,溶液质量(m) =溶液体积(V)×溶液密度(ρ)关于溶液稀释或蒸发浓缩的计算如下。稀释或浓缩前后的溶液:浓溶液的质量×其溶质的质量分数=稀溶液的质量×其溶质的质量分数=(浓溶液的质量+增加溶质的质量)×稀溶液的溶质的质量分数用两种不同质量分数(% a、% b)的溶液a、b中间质量分数溶液(c)配制成m (A)?A %+m (B)?B %=[m (A) +m (B)]?c .液体的体积分数:液体溶质的体积与溶液总体积的比就是液体的体积分数。
配制溶质质量分数一定溶液实验步骤:①计算:计算溶质质量分数配制一定溶液时所需溶质和溶剂的质量②计量:3。用托盘天平量出所需溶质的质量,放入烧杯。③近似水的密度为1g/cm3,用量筒量量质量,将量出的水倒入装有溶质的烧杯中,用玻璃棒搅拌,使溶质完全溶解。这就是所需溶质质量的溶液。
(四)固体溶解度曲线的含义(1)对同一物质在不同温度下给出不同的溶解度数值;(2)在相同温度下给出不同物质的溶解度数值;(3)给予物料溶解度受温度变化影响的大小;(4)比较在一定温度下各种物质的溶解度大小;(5)两种物质的溶解度曲线相交表示在相应温度下的溶解度相等;(6)溶解度曲线上的任何一点都是其温度下的饱和溶液,曲线表面上的任何一点都是不饱和溶液。

白色沉淀是碳酸钙,CO2 + Ca(OH)2 =CaCO3 +H2O。
44100
13 ?230。
二氧化碳的质量是13.2克。
3co +Fe2O3= 2fe + 3co2
160132
1613.2
氧化铁的质量是16克。
它的质量分数是16/20=80%。
化学学科网初三目录

在化学变化中,分子是分开的,但原子是不分开的。
分子是保持物质化学性质的最小微粒。
原子是化学变化中最小的微粒。
通常物质是由几个分子组成的,但金属有时是由原子直接组成的
原子的构成分子例如:氢原子+氧原子=水的分子。
两者同样可以构成物质如:Cu、Na、Zn等是由原子直接构成的物质;H2O, O2, H2, N2等是分子构成的物质
元素是由许多原子组成的,和分子无关

(一)溶液1、溶液:一种或几种物质分散到其他物质上,形成均匀稳定的混合物。叫溶液。
2、溶质:被溶解的物质叫做溶质。
3、溶剂:其他物质称为溶剂。
水是最常用的溶剂,汽油和酒精也是溶剂。
4、悬浊液:固体的小颗粒悬浮在液体中形成的混合物叫悬浊液,悬浊液不匀一、不稳定,一段时间就会分层。
5、浮浊液:小液滴分散在液体中形成的混合物称为浮浊液,浮浊液不均匀,不稳定,一段时间成层。
自然界、工农业生产和日常生活中经常遇到的浮液,如牛奶、石油原油、橡胶乳胶、油漆等。
浮浊液可分为两种类型:一种是油——水型,以O/W表示。
例如,植物油会分散到水里。这个分散系统是油内水外,用O/W表示。
另一种是水——油型,用W/O表示,例如:从地下开采的石油中含有少量分散的水,这种分散系水内油外,用W/O表示。
(二)溶解质1、饱和溶液在一定的温度下,在一定的溶剂中,不能再溶解某种溶质的溶液称为该溶质的饱和溶液。
2、不饱和溶液在一定温度下,在一定量的溶剂中,还能继续溶解某溶质的溶液,称为该溶质的不饱和溶液。
说明:判断一种溶液是否饱和溶液应抓住以下四点:一是在一定温度下,二是在一定量的溶剂中。
因为温度和溶剂的量改变的话,饱和溶液就会变成不饱和溶液。也就是说,饱和溶液和不饱和溶液在一定条件下可以相互转化。第三种是被溶解的物质。也就是说,溶质能否持续溶解。第四,某种物质的饱和溶液对该物质来说是饱和溶液,但对其他物质来说不是饱和溶液。在20℃时,NaCl的饱和溶液不能溶解NaCl,但可以溶解KNO3。
在同一溶质中,饱和溶液和不饱和溶液会发生变化。溶液的浓和稀是定性测量一定量溶液中所含溶质的相对量的多少。溶质多的溶液是浓度。溶质少的溶液是稀。饱和溶液不一定是浓的。不饱和溶液也不一定稀有。在20℃熟石灰的饱和溶液中,Ca(OH)2的溶解较少,是稀溶液,但在60℃时,接近饱和的KNO3溶液是浓溶液,在一定温度下,KNO3饱和溶液比相同温度下的不饱和溶液浓溶液。
(三)溶质的质量分数溶质的质量分数溶液组成的表示方法很多,溶质的质量分数是溶质的质量与溶液的质量之比。
注意:溶解度和溶质质量分数的比较三、难点知识剖析(一)溶解时的吸热和放热现象在溶解过程中发生两个变化,一个是溶质分子(或离子)向水扩散,这个过程吸收热量:另一个第一个是溶质的分子(或离子)和水分子作用,形成水合分子(或水合离子),在这个过程中放出热量。
当溶质溶解时,扩散过程的吸收热大于水合过程的释放热,表示为溶液温度的降低:扩散过程的吸收热大于水合过程的释放热,表示为溶液温度的升高;如果扩散过程中吸收的热量与水合过程中释放的热量相同,那么溶液的温度基本不变。
(二)溶解度与溶解性的区别和关系溶解性只是一般说明在某种溶剂中溶解能力的大小,是物质的一种物理性质,溶解度是测定某种物质在某种溶剂中溶解性大小的尺度,溶解性的定量表示方法,在一定温度、压力下,(三)溶质的质量分数和溶液的体积、密度的计算,溶液质量(m) =溶液体积(V)×溶液密度(ρ)关于溶液稀释或蒸发浓缩的计算如下。稀释或浓缩前后的溶液:浓溶液的质量×其溶质的质量分数=稀溶液的质量×其溶质的质量分数=(浓溶液的质量+增加溶质的质量)×稀溶液的溶质的质量分数用两种不同质量分数(% a、% b)的溶液a、b中间质量分数溶液(c)配制成m (A)?A %+m (B)?B %=[m (A) +m (B)]?c .液体的体积分数:液体溶质的体积与溶液总体积的比就是液体的体积分数。
配制溶质质量分数一定溶液实验步骤:①计算:计算溶质质量分数配制一定溶液时所需溶质和溶剂的质量②计量:3。用托盘天平量出所需溶质的质量,放入烧杯。③近似水的密度为1g/cm3,用量筒量量质量,将量出的水倒入装有溶质的烧杯中,用玻璃棒搅拌,使溶质完全溶解。这就是所需溶质质量的溶液。
(四)固体溶解度曲线的含义(1)对同一物质在不同温度下给出不同的溶解度数值;(2)在相同温度下给出不同物质的溶解度数值;(3)给予物料溶解度受温度变化影响的大小;(4)比较在一定温度下各种物质的溶解度大小;(5)两种物质的溶解度曲线相交表示在相应温度下的溶解度相等;(6)溶解度曲线上的任何一点都是其温度下的饱和溶液,曲线表面上的任何一点都是不饱和溶液。

白色沉淀是碳酸钙,CO2 + Ca(OH)2 =CaCO3 +H2O。
44100
13 ?230。
二氧化碳的质量是13.2克。
3co +Fe2O3= 2fe + 3co2
160132
1613.2
氧化铁的质量是16克。
它的质量分数是16/20=80%。