
初三化学元素周期表目录
初三化学元素周期表
一、原子序数和符号
元素周期表中的每一个元素都由一个唯一的数字标识,这个数字称为原子序数。它表示元素在周期表中的位置。元素也常用符号表示,例如氢的符号是H,氧的符号是O。
二、原子量和质子数
每个元素的原子量是其原子质量的近似值。质子数是原子核中质子的数量,它决定了元素的种类。元素的原子量和质子数对于理解元素的性质和其在周期表中的位置非常重要。
三、电子层和电子排布
电子层决定了电子在原子中的位置,而电子排布则决定了电子在这些电子层中的分布。理解电子层和电子排布有助于理解元素的化学性质。
四、元素周期表的结构
元素周期表分为七个主族、七个副族和一个0族,共18个纵行。同一族的元素具有相似的性质。周期表还有七个周期,元素按原子序数递增的顺序排列。
五、主族元素的性质
主族元素包括ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB和ⅦB族。这些元素具有相似的电子排布,因此具有相似的化学性质。例如,碱金属族的元素如锂、钠和钾具有很强的还原性。
六、过渡元素的性质
过渡元素包括铁、钴、镍、铜、锌等。这些元素具有未填满的d轨道,因此具有多种氧化态。过渡元素通常具有特殊的物理和化学性质,如磁性、高熔点和硬度等。
七、镧系和锕系元素的性质
镧系元素是从镧到铹的一组元素,锕系元素是从锕到錀的一组元素。这些元素具有相似的电子排布,但镧系和锕系元素的某些特性有所不同。例如,镧系元素具有较高的密度和熔点,锕系元素则具有放射性。
八、化学键的类型
化学键是分子或晶体中原子之间的相互作用力。不同类型的化学键会影响分子的性质。例如,离子键、共价键和金属键是三种常见的化学键类型,它们决定了分子的稳定性、熔点和导电性等性质。
九、元素的分类和作用
根据其性质和应用,元素可以分为金属、非金属和半金属等类型。金属通常具有导电性和延展性,非金属通常具有较高的电负性和氧化性,而半金属则具有特殊的导电性和光学性质。了解元素的分类有助于理解其在自然界中的作用和在工业中的应用。

1 H 氢 qing
2 He 氦 hai
3 Li 锂 li
4 Be 铍 pi
5 B 硼 peng
6 C 碳 tan
7 N 氮 dan
8 O 氧 yang
9 F 氟 fu
10 Ne 氖 nai
11 Na 钠 na
12 Mg 镁 mei
13 Al 铝 lv
14 Si 硅 gui
15 P 磷 ling
16 S 硫 liu
17 Cl 氯 lv
18 Ar 氩 ya
19 K 钾 jia
20 Ca 钙 gai

1 氢 H
2 氦 He
3 锂 Li
4 铍 Be
5 硼 B
6 碳 C
7 氮 N
8 氧 O
9 氟 F
10 氖 Ne
11 钠 Na
12 镁 Mg
13 铝 Al
14 硅 Si
15 磷 P
16 硫 S
17 氯 Cl
18 氩 Ar
19 钾 K
20 钙 Ca
初中应该就学到钙。
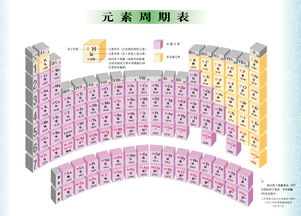
初中化学元素周期表一般要记住前20个化学元素,即
氢(H) 、氦(He)、锂(Li) 、 铍(Be) 、硼( B) 、 碳(C)、 氮(N) 、氧(o)、氟(F) 、 氖(Ne) 、 钠(Na) 、 镁(Mg) 、铝(Al) 、硅(Si) 、 磷(P) 、 硫 (S)、氯(Cl) 、 氩(Ar) 、 钾(K) 、钙(Ca)。
它有如下的记忆技巧:
钾钠银氢正一价,氟氯溴碘负一价;
钙镁钡锌正二价,通常氧是负二价
二三铁,二四碳,三铝四硅五价磷;
一三五七正价氯,二四六硫锰四七;
铜汞二价最常见,单质化合价为零。
扩展资料:
元素周期表有7个周期,16个族。
每一个横行叫作一个周期,每一个纵行叫作一个族(VIII族包含三个纵列)。
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6、7)。
共有16个族,从左到右每个纵列算一族(VIII族除外)。
例如:氢属于I A族元素,而氦属于0族元素。
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。
使其构成了一个完整的体系,被称为化学发展的重要里程碑之一。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。
失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数递增,元素金属性递增,非金属性递减。
参考资料来源:百度百科-元素周期表
初三化学元素周期表目录
初三化学元素周期表
一、原子序数和符号
元素周期表中的每一个元素都由一个唯一的数字标识,这个数字称为原子序数。它表示元素在周期表中的位置。元素也常用符号表示,例如氢的符号是H,氧的符号是O。
二、原子量和质子数
每个元素的原子量是其原子质量的近似值。质子数是原子核中质子的数量,它决定了元素的种类。元素的原子量和质子数对于理解元素的性质和其在周期表中的位置非常重要。
三、电子层和电子排布
电子层决定了电子在原子中的位置,而电子排布则决定了电子在这些电子层中的分布。理解电子层和电子排布有助于理解元素的化学性质。
四、元素周期表的结构
元素周期表分为七个主族、七个副族和一个0族,共18个纵行。同一族的元素具有相似的性质。周期表还有七个周期,元素按原子序数递增的顺序排列。
五、主族元素的性质
主族元素包括ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB和ⅦB族。这些元素具有相似的电子排布,因此具有相似的化学性质。例如,碱金属族的元素如锂、钠和钾具有很强的还原性。
六、过渡元素的性质
过渡元素包括铁、钴、镍、铜、锌等。这些元素具有未填满的d轨道,因此具有多种氧化态。过渡元素通常具有特殊的物理和化学性质,如磁性、高熔点和硬度等。
七、镧系和锕系元素的性质
镧系元素是从镧到铹的一组元素,锕系元素是从锕到錀的一组元素。这些元素具有相似的电子排布,但镧系和锕系元素的某些特性有所不同。例如,镧系元素具有较高的密度和熔点,锕系元素则具有放射性。
八、化学键的类型
化学键是分子或晶体中原子之间的相互作用力。不同类型的化学键会影响分子的性质。例如,离子键、共价键和金属键是三种常见的化学键类型,它们决定了分子的稳定性、熔点和导电性等性质。
九、元素的分类和作用
根据其性质和应用,元素可以分为金属、非金属和半金属等类型。金属通常具有导电性和延展性,非金属通常具有较高的电负性和氧化性,而半金属则具有特殊的导电性和光学性质。了解元素的分类有助于理解其在自然界中的作用和在工业中的应用。

1 H 氢 qing
2 He 氦 hai
3 Li 锂 li
4 Be 铍 pi
5 B 硼 peng
6 C 碳 tan
7 N 氮 dan
8 O 氧 yang
9 F 氟 fu
10 Ne 氖 nai
11 Na 钠 na
12 Mg 镁 mei
13 Al 铝 lv
14 Si 硅 gui
15 P 磷 ling
16 S 硫 liu
17 Cl 氯 lv
18 Ar 氩 ya
19 K 钾 jia
20 Ca 钙 gai

1 氢 H
2 氦 He
3 锂 Li
4 铍 Be
5 硼 B
6 碳 C
7 氮 N
8 氧 O
9 氟 F
10 氖 Ne
11 钠 Na
12 镁 Mg
13 铝 Al
14 硅 Si
15 磷 P
16 硫 S
17 氯 Cl
18 氩 Ar
19 钾 K
20 钙 Ca
初中应该就学到钙。

初中化学元素周期表一般要记住前20个化学元素,即
氢(H) 、氦(He)、锂(Li) 、 铍(Be) 、硼( B) 、 碳(C)、 氮(N) 、氧(o)、氟(F) 、 氖(Ne) 、 钠(Na) 、 镁(Mg) 、铝(Al) 、硅(Si) 、 磷(P) 、 硫 (S)、氯(Cl) 、 氩(Ar) 、 钾(K) 、钙(Ca)。
它有如下的记忆技巧:
钾钠银氢正一价,氟氯溴碘负一价;
钙镁钡锌正二价,通常氧是负二价
二三铁,二四碳,三铝四硅五价磷;
一三五七正价氯,二四六硫锰四七;
铜汞二价最常见,单质化合价为零。
扩展资料:
元素周期表有7个周期,16个族。
每一个横行叫作一个周期,每一个纵行叫作一个族(VIII族包含三个纵列)。
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6、7)。
共有16个族,从左到右每个纵列算一族(VIII族除外)。
例如:氢属于I A族元素,而氦属于0族元素。
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。
使其构成了一个完整的体系,被称为化学发展的重要里程碑之一。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。
失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数递增,元素金属性递增,非金属性递减。
参考资料来源:百度百科-元素周期表